「ISO 15189醫學實驗室-品質與能力要求」之改版現況
ISO 15189為國際標準化組織(International Organization for Standardization; ISO)所制定,作為國際間各類型醫學實驗室提昇自我品質與能力且滿足國際同儕共識的標準。此標準更是國際實驗室認證聯盟(ILAC)公告為各認證組織於簽署國際認證組織相互承認協議(MRA)之醫學認證方案所運用的國際標準。目前,ISO秘書處公告之ISO 15189版本為2012年版,而TAF於2000年底開始運用ISO公告國際標準於評鑑我國醫學實驗室至今,已有約245家不同類型醫學實驗室取得TAF於ISO 15189:2012認證,所認證之技術項目範圍涵蓋醫學實驗室常規提供的檢驗/檢查服務與相關特殊檢驗/檢查項目。讀者如有瞭解各類醫學實驗室之認證範圍或技術項目,歡迎至本會網頁(www.taftw.org.tw)之認證名錄查詢。
國際標準化組織(ISO)配合全球醫學科技發展與實驗室運作管理知識日趨進步,配合ISO國際標準施行審視原則,自2018年已著手辦理ISO 15189:2012標準改版規劃事宜註1。自今年5月底於ISO官網可知,經ISO技術委員會TC212相關審查作業,ISO 15189:2012版標準已完成修訂,進入國際標準草案版 (Draft International Standard; DIS) 階段,目前ISO TC212預計於今(2022)年6月至7月間,就改版修訂標準辦理最終草案版 (Final Draft International Standard; FDIS)投票,並預計ISO 15189:2022將於今(2022)年11月至12月左右發布。
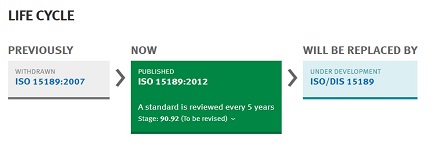 圖一、摘錄ISO官網之國際標準ISO 15189 改版進度表
圖一、摘錄ISO官網之國際標準ISO 15189 改版進度表
未來,ISO秘書處如有發布ISO/FDIS 15189之資訊,本會將於相關活動中,提供國際標準ISO 15189最終草案版(FDIS)內容之介紹。本次將就ISO 15189改版,提供摘要資訊供讀者們參考。
(一)改版後之文件架構調整
ISO 符合性評鑑委員會(CASCO)決議凡涉及符合性評鑑標準之文件,其文件的架構及內容表達方式,必需滿足該委員會(CASCO)第23號工作小組所制訂的CASCO QS-CAS-PROC/33 (ISO/CASCO 標準中的一般性元素)之要求。因此,當ISO TC212於辦理ISO 15189改版時,文件架構也須依循前述要求,規劃對應內容,亦即ISO 15189新版之文件架構與其他ISO公告符合性評鑑標準之文件架構相同,分別為:
第四章 一般要求事項 (General requirements)
第五章 架構與管理要求事項 (Structural and governance requirements)
第六章 資源要求事項 (Resource requirements)
第七章 過程要求事項 (Process requirements)
第八章 管理系統要求事項 (Management system requirements)。
依據前述文件架構,將原ISO 15189:2012版第四章節管理要求與第五章節技術要求之各章節內容,調合於前述新文件架構各章節。同時將CASCO QS-CAS-PROC/33 文件所提共同基本要素,如公正性的原則及要求(ISO/PAS 17001)、保密性的原則及要求(ISO/PAS 17002)、抱怨及申訴的原則及要求(ISO/PAS 17003)、資訊揭露及透明化(ISO/PAS 17004)及使用管理系統(ISO/PAS 17005)等,納入為改版標準原則內容。
(二)改版內容中,強調醫學實驗室應確保病患的福祉、安全及權利為原則運作。
「以病人為中心」早已是全球醫療照護與許多評鑑制度的主要考量,共同努力建構優質醫療環境。ISO/DIS 15189內容提及透過提升醫學實驗室的品質和能力來促進的病患的福祉,例如:醫學實驗室應向病患和報告使用者提供有關檢驗過程的公開資訊;也應定期審查實驗室提供的檢驗/檢查服務,以確保在臨床上的適當性;謹慎地處理與保存檢體等,均係以確保病患的福祉、安全及權利作為出發點考量,防止可能對病患、醫學實驗室人員、公眾和環境造成傷害的負面影響。
(三)改版內容有關風險管理、實驗室安全、檢體收集與傳送的部分,與ISO TC212已發布之醫學實驗室相關運作標準或技術文件內容原則一致。而第八章節管理系統要求與ISO 9001:2015 Quality management systems – Requirements內容原則一致,同時將品質管理系統一詞,變更為管理系統。舉例:
- 風險管理之要求與ISO 22367:2020 Medical laboratories – Application of risk management to medical laboratories內容原則一致。
- 實驗室安全之要求與ISO 15190:2020 Medical laboratories – Requirements for Safety內容原則一致。
- 檢體收集與傳送之要求與ISO/TS 20658:2017 Medical laboratories - Requirements for collection and transport of samples內容原則一致。
另外,對於醫學實驗室有執行Point-of-Care Testing (POCT)之相關要求,改版內容亦已涵蓋。基於前述內容,ISO TC212也決議待ISO 15189正式改版發行後,原ISO TC212所制定之ISO 22870:2016 Point-of-care testing (POCT) – Requirements for quality and competence將進行廢止。
(四)對應各章節減少文件化程序之指令型要求,改以文件化資訊精神取代,讓醫學實驗室於運作更具彈性。
改版內容大幅減少使用文件化程序 (documented procedure) 一詞,讓醫學實驗室依自身流程規劃、運作與管制的需求,將相關文件或程序文件化至必要程度,以確保實驗室活動的一致性和結果的有效性。
本會為亞太認證合作組織 (APAC) 與國際實驗室認證聯盟 (ILAC) 醫學領域相互認可協議的會員國之一,自2009年起以ILAC觀察員身份參與ISO TC212會議,以瞭解ISO 15189標準制度與取得國際標準發展最新訊息。本會將就所獲得資訊運用於國內醫學實驗室,以促成國內醫學實驗室運作可持續與國際接軌。
對於國際符合性評鑑標準改版,原則應於3年內完成所有獲認證符合性評鑑機構(如認證醫學實驗室)轉換符合新版標準內容,以持續維持國際認證相互承認協議之要求。因此,本會除透過參與國際標準相關訓練與國際認證組織相關會議,持續關注國際標準改版發展,並將所獲得國際同儕於推動符合性評鑑機構符合新版標準的相關經驗或知識分享給認證醫學實驗室與國內權責機關外,同時亦將於適當時間公告有關本會認證醫學實驗室於改版標準之轉換政策與措施,並辦理標準訓練,以協助各認證醫學實驗室完成轉換事宜。最後,請各醫學實驗室專家與先進除可持續關注ISO 15189改版正式公告外,對於後續轉換標準之相關活動,也請大家能多多協助與支持參與。
註1:國際標準修訂/改版流程:
1.依據ISO秘書處規劃有關國際標準制定流程,為經起草工作小組提議(NWIP)、技術委員會草案版(Committee draft; CD)、國際標準草案版(Draft International Standard; DIS)、國際標準最終草案版(Final Draft International Standard; FDIS)及正式國際標準(International Standard; IS)。
2.前述每階段過程,對應文件皆需經由技術委員會成員審查意見及投票決定,依ISO秘書處所制定規則確認同意後,才會逐次進入下一階段。


