「ISO 22367:2020 醫學實驗室-風險管理於醫學實驗室的應用」標準簡介
「ISO 22367:2020 醫學實驗室—風險管理於醫學實驗室的應用」是國際標準化組織(ISO)於2020年發布,係由ISO/TC 212臨床實驗室測試與體外診斷測試系統技術委員會所撰寫,並取代技術文件ISO/TS 22367:2008,成為第1版標準文件。與ISO/TS 22367:2008技術文件相比,ISO 22367:2020主要的差異在於變更了文件標題,內容更著重於醫學實驗室所有流程整體性的風險管理,以及排除持續改進的說明等。
醫學實驗室符合性評鑑標準「ISO 15189:2012醫學實驗室—品質與能力要求」提及,醫學實驗室應檢視其工作流程,評估潛在失效對於檢驗結果所造成的衝擊,透過調整流程以降低或排除已鑑別的風險,並將決定及採行的措施予以文件化。而ISO 22367:2020 (以下簡稱標準文件) 則提供了醫學實驗室一個經驗、洞察力與判斷的架構,用以管理實驗室檢驗的相關風險。而醫學實驗室的檢驗方法,通常為使用體外診斷醫療器材,因此本標準文件內容,亦參考醫療器材製造商採行的「ISO 14971:2007醫療器材—醫療器材風險管理」內容,採行相同概念、原則、架構進行撰寫。至於醫學實驗室如已採行風險管理系統ISO 31000於其系統並同時使用ISO 22367:2020於運作管理,實際上此兩份文件未有衝突性而有相互協調性,尤其如涉及業務、營運、道德、法令、法規之影響風險,是可經由ISO 31000的系統模式予以適當監控與管理。
此標準文件主要內容在於醫學實驗室應針對檢驗相關的病人、實驗室員工及醫療照護提供者,進行風險鑑別與管理的流程,同時應建立、文件化、實施並維持一套風險管理流程,此流程透過鑑別與實驗室檢驗及服務相關的危害、估計與評估相關風險、控制風險、以及監控控制措施的方式達成風險管理的成效。此風險管理的流程通常應包含下列要項(步驟):
- 風險管理計畫;
- 風險分析;
- 風險評估;
- 風險控制;
- 風險管理審查;以及
- 風險監控
整體流程以下圖流程簡要敘述:
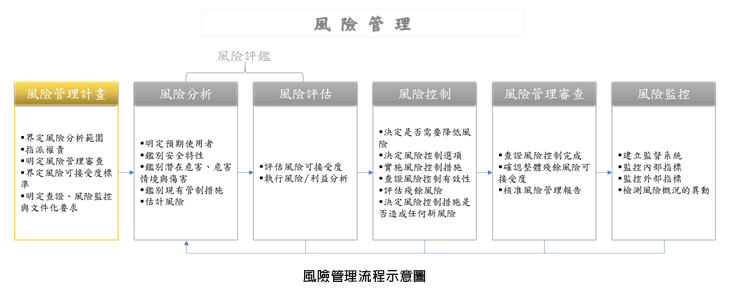 風險管理流程示意圖
風險管理流程示意圖
醫學實驗室實施此標準文件之風險管理流程時,應由管理階層提供適當資源與指派適任人員,並界定與文件化實驗室的風險管理政策、核准所有風險評鑑與風險管理報告,以及定期檢視風險管理流程適當性,以確保流程持續有效。
整體而言,此標準文件已提供醫學實驗室於導入ISO 15189:2012第4.14.6節實施風險管理的參考資訊。因此,本會於2011年曾依據ISO/TS 22367:2008制定與發佈「醫學實驗室-利用風險管理與持續改善來減少錯誤(TAF-CNLA-G26)」指引文件,引導醫學實驗室導入管理風險概念。為因應此新版文件之發行,並協助本會認證醫學實驗室持續將ISO 22367:2020概念繼續延伸銜接,本會已預將ISO 22367:2020此文件概念於今(2021)年下半年,制定對應指引性文件,以提供醫學實驗室於其實驗室風險管理應用與參考。


